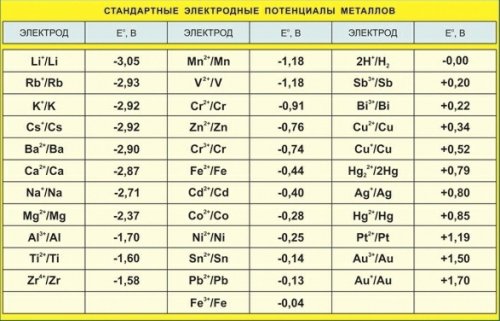
ما هي إمكانات القطب
جهد القطب أو جهد القطب الكهربائي لمعدن هو فرق محتمل يحدث في واجهة المحلول المعدني عندما ينغمس معدن في محلول إلكتروليت نتيجة تفاعل ذرات أيون المعدن السطحي الموجودة في عقد شبكة بلورية مع قطبية جزيئات الماء موجهة إلى سطح القطب ... هذا بسبب تكوين طبقة كهربائية مزدوجة ، أي توزيع غير متماثل للجسيمات المشحونة عند الحدود.
تُستخدم ظاهرة انحلال المعادن في الإلكتروليتات في المصادر الكيميائية للكهرباء. تميل الصفيحة المعدنية التي يتم تدخينها في محلول ملح خاص بها ، بطريقة أو بأخرى ، إلى الذوبان فيها. يسمى هذا الاتجاه أحيانًا مرونة انحلال المعدن.
صفيحة الزنك المغمورة في محلول من كبريتات الزنك ZnTAKA4 تعطي جزيئات الزنك للمحلول على شكل أيونات موجبة الشحنة.بسبب حقيقة أن الذرات الوردية تترك في شكل أيونات موجبة الشحنة ، يتم تكوين فائض من الإلكترونات الحرة على صفيحة الزنك وتصبح سالبة الشحنة ، ويتكون فائض من الأيونات الموجبة في طبقة السائل بالقرب من السطح من الزنك ، وبالتالي يتم تحميل هذه الطبقة بشكل إيجابي. بهذه الطريقة ، تنشأ طبقة كهربائية مزدوجة من الشحنات المنفصلة مكانيًا لعلامة معاكسة عند السطح البيني بين السائل والمعدن.
سوف تعارض هذه الشحنات المرور الإضافي للمعدن إلى المحلول - تحمل الصفائح السالبة أيون المعدن الموجب ، وتدفع الشحنة الموجبة للإلكتروليت أيون المعدن إلى الخلف باتجاه اللوحة. بعبارة أخرى ، المجال الكهربائي للطبقة المزدوجة في الواجهة المعدنية السائلة يتعارض مع الانتقال الإضافي للأيونات المعدنية إلى محلول. يتم إنشاء توازن بين قوى ميل المعدن للذهاب إلى المحلول ، كيميائي بطبيعته ، و القوى الكهربائية التي تعارض.
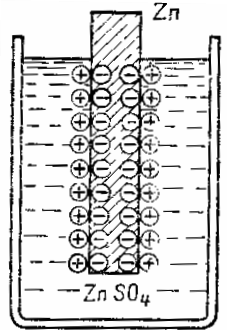
رسم تخطيطي لتشكيل طبقة كهربائية مزدوجة عند السطح البيني بين معدن وإلكتروليت
وهكذا ، بسبب الانحلال في الإلكتروليت ، يكتسب القطب المعدني قطبًا كهربائيًا معينًا (بمعنى آخر ، كهروكيميائي) فيما يتعلق بالكهرباء ، والذي يعتمد على مادة القطب وتكوين الإلكتروليت.
ومع ذلك ، يمكن أن تكون جهود القطب موجبة. يحدث هذا في الحالات التي تنتقل فيها الأيونات الموجبة للمحلول إلى القطب ، وشحنها بشكل إيجابي ، وطبقة الإلكتروليت - بشكل سلبي ، على سبيل المثال ، عندما يتم غمر صفيحة نحاسية في محلول مركّز بدرجة كافية من كبريتات النحاس (CuSO) 4).
يمكن تشبيه الطبقة المزدوجة الكهربائية بمكثف ، أحدهما عبارة عن سطح معدني والآخر عبارة عن طبقة من الأيونات في محلول على السطح المعدني. بين الصفائح المشحونة عكسيا وهناك فرق ، أو قفزة ، في الجهد.
يمكن أن تعمل القفزة المحتملة في واجهة محلول الإلكترود كمقياس لقدرة الأكسدة والاختزال للنظام. ومع ذلك ، من المستحيل قياس مثل هذه القفزة المحتملة أو ، على نحو مكافئ ، فرق الجهد بين المرحلتين. ولكن يمكنك قياس البريد. إلخ. ج.العناصر المكونة من الأقطاب الكهربائية التي نهتم بها وبعضها (نفس الشيء في جميع الحالات) قطب كهربائي ، يُفترض بشكل مشروط أن تكون إمكاناته صفرًا.
تم قياسه ، إلخ. ج.يميز سعة الأكسدة والاختزال للقطب الذي نهتم به بالنسبة إلى بعض الصفر الشرطي. تسمى القيمة التي يتم الحصول عليها بهذه الطريقة الإمكانات الداخلية للمعدن.
لقياس جهد القطب الكهربائي لأي معدن ، من الضروري وضع قطب كهربائي ثانٍ في الإلكتروليت ، والذي بدوره سيكون له جهد قطب كهربائي معين ، اعتمادًا على مادته. لذلك ، يمكن فقط قياس المجموع الجبري لإمكانيات قطب كهربي مباشرة.
لهذا السبب ، يتم تحديد إمكانات الإلكترود للمواد المختلفة فيما يتعلق بالمعيار (قطب هيدروجين ، والذي عادة ما يتم اعتبار إمكاناته صفرًا.
يمكن أيضًا استخدام أقطاب مرجعية أخرى للقياس تُعرف إمكاناتها بالنسبة إلى القطب القياسي للهيدروجين. تم العثور على هذه الإمكانات أيضًا بناءً على قياس البريد. إلخ. ج - دائرة تتكون من قطب مرجعي مختار وقطب هيدروجين قياسي.
إذا كان القطب المدروس المتصل بقطب هيدروجين معياري سالبًا ، فإن العلامة "-" تُخصص للجهد الداخلي ، وإلا فإن الإشارة «+».
على سبيل المثال ، يتم تحديد جهد القطب الكهربائي للزنك -0.76 فولت ، والنحاس +0.34 فولت ، والفضة +0.8 فولت ، المقاس بهذه الطريقة في محلول من الملح المعدني المقابل ، عن طريق طرح الجهد السالب الأكثر من الجهد الموجب.
إذا تم وضع لوحين معدنيين لهما جهد قطب كهربائي مختلف في المنحل بالكهرباء المقابل ، على سبيل المثال ، في محلول من حمض الكبريتيك (H2SO4) وضع الزنك (Zn) والنحاس (Cth) ، فإن مقياس الفولتميتر المتصل بهذه الألواح سيظهر جهدًا بين لهم أكثر بقليل من 1 V.
هذا الجهد ، في هذه الحالة يسمى e. إلخ. ج. زوج كلفاني ، سيكون بسبب الاختلاف في إمكانات القطب للنحاس ، والتي لها جهد إيجابي صغير ، والزنك ، الذي له جهد سلبي كبير. مثل هذا الجهاز هو أبسط خلية كلفانية - خلية فولتا.
في الخلية الجلفانية ، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية وبمساعدتها يمكن إجراء الأعمال الكهربائية بسبب طاقة التفاعل الكيميائي.
قياس البريد. إلخ. ج.يجب إنتاج الخلايا الجلفانية في حالة عدم وجود تيار في دائرة الخلية. خلاف ذلك ، يتم قياس البريد. إلخ. s. أقل من القيمة المحددة على أنها الفرق بين إمكانات التوازن للقطبين... في الواقع ، فإن تركيزًا معينًا من الإلكترونات على الأقطاب الكهربائية يتوافق مع إمكانية التوازن: فكلما كانت موجبة أكثر ، كانت أقل ، كلما زادت سالبة. وفقًا لذلك ، تختلف بنية ذلك الجزء من الطبقة المزدوجة الموجودة في المحلول أيضًا.
قياس البريد. إلخ. مععادة ما يتم إنتاج خلية بدون تدفق تيار بواسطة طريقة التعويض. لتطبيقه ، يجب أن يكون لديك بعض معيار البريد إلخ. مع يعمل ما يسمى بالعنصر العادي كمعيار. الأكثر شيوعًا أنهم يستخدمون عنصر ويستون الزئبق والكادميوم العادي ، على سبيل المثال إلخ. الذي يساوي 1.01830 فولت عند 20 درجة مئوية.