تتصرف الإلكترونات مثل الموجات
لطالما عرف الفيزيائيون أن الضوء عبارة عن موجة كهرومغناطيسية. حتى يومنا هذا ، لا أحد يشك في هذا الموقف ، لأن الضوء يوضح بوضوح جميع علامات سلوك الموجة: يمكن أن تتداخل الموجات الضوئية مع بعضها البعض ، مما يؤدي إلى إنشاء نمط تداخل ، كما أنها قادرة على الفصل والانحناء حول العوائق على طول فترة الانعراج.
عندما نرى طائرًا يمشي مثل البطة ، يسبح مثل البطة ، ويصيح مثل البطة ، نسمي ذلك الطائر بطة. إذن الضوء موجه كهرومغناطيسيةاستنادًا إلى العلامات التي تم ملاحظتها بشكل موضوعي لسلوك مثل هذه الموجة في الضوء.

ومع ذلك ، في أواخر القرن التاسع عشر والقرن العشرين ، بدأ الفيزيائيون الحديث عن "ثنائية موجة الجسيمات" للضوء. اتضح أن معرفة أن الضوء عبارة عن موجة كهرومغناطيسية ليس كل ما يعرفه العلم عن الضوء. اكتشف العلماء ميزة مثيرة للاهتمام للغاية في الضوء.
اتضح أن الضوء يتجلى بطريقة ما على أنه سلوك تيار من الجسيمات بطريقة ما.وجد أن الطاقة التي يحملها الضوء ، بعد أن يتم عدها خلال فترة زمنية معينة بواسطة كاشف خاص ، تبين أنها تتكون على أي حال من قطع فردية (كاملة).
لذلك ، أصبح صحيحًا أن طاقة الضوء منفصلة ، لأنها تتكون ، كما كانت ، من جسيمات فردية - "كوانتا" ، أي من أصغر أجزاء كاملة من الطاقة. يسمى هذا الجسيم من الضوء ، الذي يحمل وحدة (أو كمية) من الطاقة ، بالفوتون.
يتم العثور على طاقة فوتون واحد بالصيغة التالية:
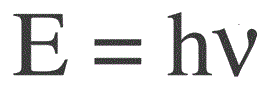
E - طاقة الفوتون ، h - ثابت بلانك ، التردد الخامس.
أسس الفيزيائي الألماني ماكس بلانك بشكل تجريبي حقيقة انحراف الموجة الضوئية وحساب قيمة الثابت h ، الذي يظهر في صيغة إيجاد طاقة الفوتونات الفردية. تبين أن هذه القيمة هي: 6.626 * 10-34 J * s. نشر بلانك نتائج عمله في أواخر القرن العشرين.

تأمل ، على سبيل المثال ، شعاع أرجواني. تردد مثل هذا الضوء (f أو v) هو 7.5 * 1014 هرتز ثابت بلانك (h) هو 6.626 * 10-34 J * s. هذا يعني أن طاقة الفوتون (E) المميزة للون البنفسجي هي 5 * 10-19 J. وهذا جزء صغير من الطاقة يصعب جدًا التقاطه.
تخيل تيارًا جبليًا - يتدفق كوحدة واحدة ، ومن المستحيل أن ترى بالعين المجردة أن التيار يتكون بالفعل من جزيئات ماء فردية. ومع ذلك ، فإننا نعلم اليوم أن الجسم العياني - التدفق - هو في الواقع منفصل ، أي أنه يتكون من جزيئات فردية.
هذا يعني أنه إذا تمكنا من وضع عداد جزيء بجوار التيار لعد جزيئات الماء التي تمر أثناء تدفق التيار ، فسيقوم الكاشف دائمًا بحساب الأعداد الصحيحة فقط من جزيئات الماء ، وليس الجزئي منها.
وبالمثل ، فإن الرسم البياني للطاقة الإجمالية للفوتون E ، المحسوب في الوقت t - سيتحول دائمًا إلى أنه ليس خطيًا (الشكل الأصفر) ، ولكنه متدرج (الشكل الأخضر):
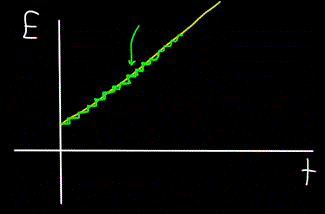
لذلك ، تتحرك الفوتونات ، وتحمل الطاقة ، وبالتالي يكون لها زخم. لكن الفوتون ليس له كتلة. فكيف يمكنك أن تجد الزخم؟
في الواقع ، بالنسبة للأجسام التي تتحرك بسرعات قريبة من سرعة الضوء ، فإن الصيغة الكلاسيكية p = mv هي ببساطة غير قابلة للتطبيق. لفهم كيفية إيجاد الزخم في هذه الحالة غير العادية ، دعنا ننتقل إلى النسبية الخاصة:
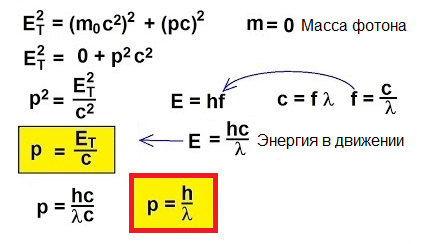
في عام 1905 ، أوضح ألبرت أينشتاين من وجهة النظر هذه التأثير الكهروضوئي... نعلم أن الصفيحة المعدنية بها إلكترونات بداخلها تنجذب بداخلها بواسطة نوى الذرات موجبة الشحنة وبالتالي يتم الاحتفاظ بها في المعدن. ولكن إذا قمت بتألق مثل هذه اللوحة بضوء تردد معين ، فيمكنك إخراج الإلكترونات من اللوحة.
يبدو الأمر كما لو أن الضوء يتصرف مثل تيار من الجسيمات ذات الزخم ، وعلى الرغم من أن الفوتون ليس له كتلة ، إلا أنه يتفاعل بطريقة ما مع الإلكترون في المعدن ، وفي ظل ظروف معينة يكون الفوتون قادرًا على ضرب الإلكترون.
لذلك إذا كان لسقوط الفوتون على اللوحة طاقة كافية ، فسيتم إخراج الإلكترون من المعدن ويخرج من اللوحة بسرعة v. يسمى هذا الإلكترون الضار بالفوتوإلكترون.
نظرًا لأن الإلكترون المطروح له كتلة معروفة m ، فسيكون له طاقة حركية معينة mv.
يتم تحويل طاقة الفوتون ، عند تأثيره على المعدن ، إلى طاقة خروج الإلكترون من المعدن (وظيفة العمل) وإلى الطاقة الحركية للإلكترون ، التي يبدأ الإلكترون المطرود في التحرك من المعدن ، وتركه.
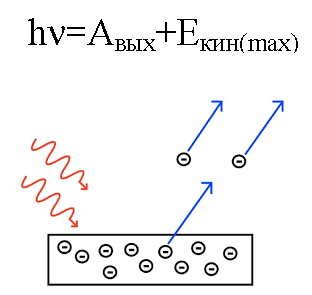
لنفترض أن فوتونًا ذا طول موجي معروف يصطدم بسطح معدن تُعرف فيه وظيفة الشغل (إلكترون من المعدن). في هذه الحالة ، يمكن بسهولة العثور على الطاقة الحركية للإلكترون المنبعث من معدن معين ، وكذلك سرعته.
إذا كانت طاقة الفوتون غير كافية للإلكترون لأداء وظيفة العمل ، فعندئذ لا يمكن للإلكترون ببساطة أن يترك سطح المعدن المحدد ولا يتشكل الإلكترون الضوئي.
في عام 1924 ، عالم فيزياء فرنسي لويس دي بروجلي طرح فكرة اختراق وفقًا لها ليس فقط فوتونات الضوء ولكن الإلكترونات نفسها يمكن أن تتصرف مثل الموجات. حتى أن العالم اشتق معادلة للطول الموجي الافتراضي للإلكترون. سميت هذه الموجات فيما بعد "موجات دي برولي".
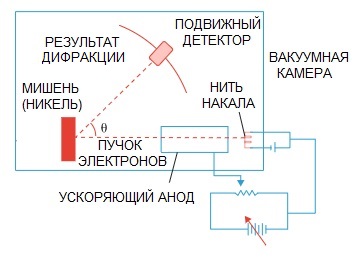
تم تأكيد فرضية De Broglie لاحقًا. تجربة فيزيائية حول حيود الإلكترون ، أجراها العالمان الأمريكيان كلينتون دافيسون وليستر جيرمر عام 1927 ، أشارت أخيرًا إلى طبيعة موجة الإلكترون.
عندما تم توجيه حزمة من الإلكترونات من خلال بنية ذرية خاصة ، يبدو أن الكاشف كان يجب أن يسجل الصورة كجسيمات تتطاير واحدة تلو الأخرى ، وهو أمر متوقع منطقيًا إذا كانت الإلكترونات جسيمات.
لكن في الممارسة العملية لدينا صورة مميزة لانحراف الموجة. علاوة على ذلك ، تتوافق أطوال هذه الموجات تمامًا مع المفهوم الذي اقترحه دي برولي.
في النهاية ، أتاحت فكرة دي بروي شرح مبدأ نموذج بوهر الذري ، ثم أتاحت لاحقًا لإروين شرودنغر تعميم هذه الأفكار ووضع أسس فيزياء الكم الحديثة.
